2026年1月26日��,為全面落實長三角一體化發(fā)展國家戰(zhàn)略���,推進醫(yī)療器械審評標準區(qū)域統(tǒng)一,在《長三角區(qū)域醫(yī)療器械技術(shù)審評合作協(xié)議》框架下��,上海市醫(yī)療器械化妝品審評核查中心���、江蘇省藥品監(jiān)督管理局審評中心����、浙江省醫(yī)療器械審評中心���、安徽省藥品審評查驗中心共同組織制定了可穿戴式心電記錄設(shè)備產(chǎn)品技術(shù)審評要點����,一起來看具體內(nèi)容。
2026年1月26日�,為全面落實長三角一體化發(fā)展國家戰(zhàn)略,推進醫(yī)療器械審評標準區(qū)域統(tǒng)一��,在《長三角區(qū)域醫(yī)療器械技術(shù)審評合作協(xié)議》框架下����,上海市醫(yī)療器械化妝品審評核查中心、江蘇省藥品監(jiān)督管理局審評中心��、浙江省醫(yī)療器械審評中心����、安徽省藥品審評查驗中心共同組織制定了可穿戴式心電記錄設(shè)備產(chǎn)品技術(shù)審評要點,一起來看具體內(nèi)容��。
江浙滬皖長三角區(qū)域可穿戴式心電記錄設(shè)備產(chǎn)品技術(shù)審評要點
本審評要點旨在指導(dǎo)注冊申請人對可穿戴式心電記錄設(shè)備產(chǎn)品注冊申報資料的準備及撰寫����,同時也為技術(shù)審評部門審評注冊申報資料提供參考。
本審評要點是供注冊申請人和技術(shù)審評人員使用的指導(dǎo)性文件��,但不包括注冊審批所涉及的行政事項��,亦不作為法規(guī)強制執(zhí)行�,應(yīng)在遵循相關(guān)法規(guī)的前提下使用本審評要點。如果有能夠滿足相關(guān)法規(guī)要求的其他方法���,也可以采用��,但是需要提供詳細的研究資料和驗證資料���。
本審評要點是在現(xiàn)行法規(guī)和標準體系以及當前認知水平下制定的,隨著法規(guī)和標準的不斷完善����,以及科學(xué)技術(shù)的不斷發(fā)展,相關(guān)內(nèi)容也將適時進行調(diào)整���。
一�、適用范圍
本審評要點適用于可穿戴式心電記錄設(shè)備產(chǎn)品的注冊申報�。
該類產(chǎn)品結(jié)構(gòu)特征上具有顯著的“穿戴式”特點。
可穿戴式心電記錄設(shè)備產(chǎn)品使用心電電極/心電傳感器(下文簡稱為“心電電極”)來采集人體心臟電生理信號�,在計算終端進行信號的處理與顯示,或者心電電極與心電處理器為一體化設(shè)計���。
本審評要點不適用的產(chǎn)品:直接采集非電信號來記錄心臟生
理活動的設(shè)備���,如“心沖擊”信號1�、PPG(光電容積描記術(shù))心率信號2���。
二����、產(chǎn)品簡介
可穿戴式心電記錄設(shè)備產(chǎn)品通過配套的心電電極采集用戶心臟活動電位����,得到各測量點之間的電位差,內(nèi)部處理器對心電信號進行放大��、換算�、濾波后,通過無線網(wǎng)絡(luò)傳輸至終端����,終端軟件對信號進行算法處理后,在軟件界面上顯示心電曲線和心率值等結(jié)果;或直接在可穿戴終端顯示結(jié)果�。
結(jié)構(gòu)組成:產(chǎn)品一般由可穿戴的心電電極(包括電極和其他模塊)、充電盒(如有)��、充電線(如有)、電源適配器和軟件(專用型獨立軟件�、內(nèi)嵌型軟件組件)組成。內(nèi)嵌型軟件組件:一般包括信號采集��、信號處理�、硬件控制等模塊�。專用型獨立軟件(如有):一般為移動通信終端上用于顯示心電相關(guān)信息的應(yīng)用軟件(包括APP)。
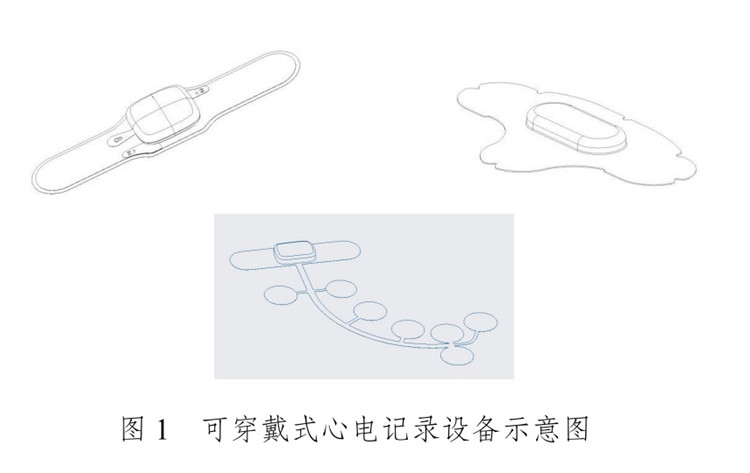
產(chǎn)品常見形態(tài)中����,部分產(chǎn)品的電極/傳感器部分與信號處理等主體部分具有物理連接;而分體式產(chǎn)品的電極/傳感器部分與主體部分物理分離,常見形式有電極/傳感器通過無線信號與主體部分產(chǎn)生信號連接����。產(chǎn)品舉例示意圖如圖1所示。
三�、審評主要關(guān)注點
在參照相關(guān)法規(guī)、規(guī)章���、指導(dǎo)原則����、標準的情況前提下����,結(jié)合下列關(guān)注點開展技術(shù)審評��。
(一)綜述資料
按照《關(guān)于公布醫(yī)療器械注冊申報資料要求和批準證明文件格式的公告》(國家藥監(jiān)局2021年第121號)提交申報資料���。1.產(chǎn)品名稱:
應(yīng)符合《醫(yī)療器械通用名稱命名規(guī)則》、《醫(yī)用診察和監(jiān)護器械通用名稱命名指導(dǎo)原則》的要求��,命名規(guī)范參考如下:
產(chǎn)品名稱中若使用“導(dǎo)聯(lián)”“單導(dǎo)”“X導(dǎo)”等表述���,導(dǎo)聯(lián)使用位置應(yīng)符合“標準12導(dǎo)聯(lián)系統(tǒng)””的定義要求����。當前已上市的產(chǎn)品名稱舉例:“貼片式動態(tài)心電記錄儀”�、“穿戴式動態(tài)心電記錄儀”等。
2.分類編碼:
結(jié)合已上市產(chǎn)品的分類界定結(jié)果��,該產(chǎn)品為第二類醫(yī)療器械(除ST段��、QT/QTc����、心律失常的分析)。按照2017版《醫(yī)療
器械分類目錄》��,分類編碼為07-03-01。
若產(chǎn)品存在新功能����,該產(chǎn)品應(yīng)按照要求開展分類界定工作以確定類別。
3.型號規(guī)格:
應(yīng)說明型號規(guī)格的劃分依據(jù)��、明確各型號規(guī)格的區(qū)別��?��?刹捎脤Ρ缺砘驇в姓f明性文字的圖片、圖表��,對不同型號規(guī)格的結(jié)構(gòu)組成��、性能指標加以描述��。
4.結(jié)構(gòu)組成:
應(yīng)提供產(chǎn)品組成各部分的結(jié)構(gòu)示意圖���,包括心電測量終端的細節(jié)���,并說明各部件的功能。
5.產(chǎn)品描述
產(chǎn)品的原理描述需詳細說明傳感器的工作原理;明確微處理器的換算��、處理、修正的流程��。
6.產(chǎn)品適用范圍和禁忌證
(1)適用范圍:產(chǎn)品的適用范圍應(yīng)與申報產(chǎn)品功能��、臨床應(yīng)用范圍相一致���。通常描述為:產(chǎn)品用于測量���、采集、觀察和存儲心電信號�,供臨床診斷。
(2)適用人群:應(yīng)明確目標患者人群的信息���。
(3)禁忌證:如產(chǎn)品具有禁忌證�,應(yīng)予以說明�。并應(yīng)當明確說明該器械不適宜應(yīng)用的某些疾病、情況或特定的人群����。
(二)非臨床資料
1.產(chǎn)品風(fēng)險管理資料
按照121號公告提交,并在研究資料部分進一步提供相關(guān)資料����,重點關(guān)注以下風(fēng)險:
(1)電池漏液導(dǎo)致產(chǎn)品損壞���,嚴重時起火。
(2)測量過程中未牢固佩戴����,影響檢測結(jié)果。
(3)測量部位不正確���,導(dǎo)致測量誤差過大���。
(4)測量過程中體動,導(dǎo)致測量失敗��。
(5)長期使用導(dǎo)致信號偏移或者使用部位皮膚過敏����。
2.產(chǎn)品技術(shù)要求及檢驗報告
產(chǎn)品技術(shù)要求格式可參考《醫(yī)療器械產(chǎn)品技術(shù)要求編寫指導(dǎo)原則》�。
產(chǎn)品技術(shù)要求中推薦包括以下性能指標:
(1)外觀與結(jié)構(gòu)要求
產(chǎn)品外表面應(yīng)平整光滑,色澤均勻���,無明顯劃痕��、毛刺����、鋒棱和變形現(xiàn)象。
產(chǎn)品文字和標志應(yīng)準確����、清晰易認。
(2)整體性能要求
線性和動態(tài)范圍���。
輸入阻抗��。
共模抑制���。
增益準確度。
增益穩(wěn)定性�。
系統(tǒng)噪聲。
通道串擾���。(單導(dǎo)聯(lián)產(chǎn)品不適用)
頻率響應(yīng)�。
時間準確度��。
時間軸對齊����。(單導(dǎo)聯(lián)產(chǎn)品�、結(jié)構(gòu)組成無顯示/打印部件產(chǎn)品不適用)
持續(xù)監(jiān)測時間(宣稱動態(tài)的產(chǎn)品應(yīng)不少于24小時)��。
電池狀態(tài)顯示或供電能力�。
數(shù)據(jù)保存能力。
(3)與患者接觸部分要求
持粘力��。
柔順性���。
液體耐受性����。
耐折����、耐繞曲等相關(guān)性能。
(4)專用型獨立軟件要求(如適用)
依據(jù)說明書和用戶界面明確軟件供用戶調(diào)用的全部功能(含安全功能)綱要���,注明選裝、自動功能�。
參照《醫(yī)療器械軟件注冊審查指導(dǎo)原則(2022年修訂版)》適用的性能要求。
(5)網(wǎng)絡(luò)安全(如適用)
網(wǎng)絡(luò)條件(若適用��,含網(wǎng)絡(luò)架構(gòu)、網(wǎng)絡(luò)類型��、網(wǎng)絡(luò)帶寬)�,涵蓋客戶端、服務(wù)器端(若適用)要求���。
接口:供用戶調(diào)用的應(yīng)用程序接口(如適用)��、數(shù)據(jù)接口和產(chǎn)品接口(如適用)��,均需明確傳輸協(xié)議��、存儲格式����。
性能效率(如適用)��。
用戶使用限制(如適用)�。
(6)系統(tǒng)安全
電氣安全要求:應(yīng)符合GB9706.1-2020、YY9706.102-2021�、YY9706.247-2021(非動態(tài)產(chǎn)品可根據(jù)產(chǎn)品特點適用部分條款)的相關(guān)要求。如產(chǎn)品可用于家庭環(huán)境��,還應(yīng)符合YY9706.111-2021的相關(guān)要求���。
3.研究資料
3.1物理和機械性能研究
除根據(jù)“2021年第121號公告”要求的內(nèi)容外��,還應(yīng)提交以下研究資料�。
需提供電池的燃爆風(fēng)險研究資料?�?紤]電源續(xù)航能力����,應(yīng)關(guān)注終端計算能力(如采集、信號的前處理)和電源續(xù)航能力的適配性���。
如產(chǎn)品在說明書中宣稱可在非靜息狀態(tài)下測量���,應(yīng)提供產(chǎn)品在運動狀態(tài)下測量準確性的研究資料,考量因素可包括肌電干擾�、極化電壓變化等。
3.2化學(xué)/材料表征研究
根據(jù)“2021年第121號公告”要求提交資料���。3.3電氣系統(tǒng)安全性研究
根據(jù)“2021年第121號公告”要求提交資料�。
3.4輻射安全研究
不適用����。
3.5軟件研究
申請人應(yīng)按照《醫(yī)療器械軟件注冊審查指導(dǎo)原則(2022年修訂版)》的相關(guān)要求提供資料。網(wǎng)絡(luò)安全研究資料部分�,應(yīng)按照《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則(2022年修訂版)》的相關(guān)要求提供資料。產(chǎn)品若通過電子接口與其他醫(yī)療器械或非醫(yī)療器械交換并使用信息�,應(yīng)當提供互操作性研究資料,包括基本信息�、需求規(guī)范、風(fēng)險管理���、驗證與確認��、維護計劃等內(nèi)容���。核心功能部分,需明確產(chǎn)品心電處理算法��,并提供算法有效性驗證資料�,如信號采集處理、參數(shù)計算等����。其中參數(shù)計算應(yīng)首先明確最終輸出的參數(shù)名稱,再明確計算公式以及所使用的參考數(shù)據(jù)庫(若有)����。
對于采用藍牙�、WIFI��、4G/5G����、WMTS等無線方式進行數(shù)據(jù)傳輸?shù)漠a(chǎn)品,建議參考醫(yī)療器械遠程傳輸功能有關(guān)技術(shù)文件提交研究資料����。
3.6生物學(xué)特性研究
產(chǎn)品與患者直接接觸,根據(jù)“2021年第121號公告”“國食藥監(jiān)械[2007]345號”要求提交資料����。
3.7清潔、消毒���、滅菌研究
可穿戴式心電記錄設(shè)備通常為非無菌產(chǎn)品�,應(yīng)定期進行清潔和消毒��。應(yīng)列出清潔和消毒工藝�,提供對推薦使用的消毒劑進行評價試驗的記錄。
對于以無菌狀態(tài)交付的產(chǎn)品����,應(yīng)明確滅菌工藝(方法和參數(shù))和無菌保證水平(SAL)��,并提供滅菌驗證及確認的相關(guān)研究資料。以非無菌狀態(tài)交付�,若注冊人宣稱產(chǎn)品需進行微生物控制,其環(huán)境控制要求���、生產(chǎn)控制要求�,可參照生產(chǎn)企業(yè)滅菌���。
3.8可用性/人為因素研究
可穿戴式心電記錄設(shè)備屬于中����、低使用風(fēng)險醫(yī)療器械��,可提交使用錯誤評估報告���。若前期已開展可用性工程工作���,亦可提交可用性工程研究報告,用于替代使用錯誤評估報告����。
3.9穩(wěn)定性研究
可參照《有源醫(yī)療器械使用期限注冊技術(shù)審查指導(dǎo)原則》的相關(guān)要求�,提供使用期限研究資料��。
可以參照GB/T14710標準的要求及產(chǎn)品使用(溫度�、濕度、氣壓���、電源)���、運輸、儲存條件開展環(huán)境試驗研究�。
3.10其他資料
根據(jù)《免于臨床評價醫(yī)療器械目錄(2025年)》,產(chǎn)品屬于免于臨床評價的產(chǎn)品���,注冊申請人應(yīng)根據(jù)《列入免于臨床評價醫(yī)療器械目錄產(chǎn)品對比說明技術(shù)指導(dǎo)原則》提交相關(guān)資料��。
但基于目前市場上可穿戴式心電記錄設(shè)備使用了非標準的“導(dǎo)聯(lián)”電極(例如��,電極放置位置與國際指南定義的“標準12導(dǎo)聯(lián)”位置有較大差異)����,也有部分產(chǎn)品使用了無液態(tài)導(dǎo)電介質(zhì)的電極��。因此建議補充同類產(chǎn)品的臺架試驗對比。
按照YY9706.247-2021的要求��,如果產(chǎn)品聲稱可以測量心率變異性(HRV)或RR間期變異性(RRV)����,應(yīng)關(guān)注申報產(chǎn)品和對照產(chǎn)品在這兩個功能上的準確性是否滿足臨床要求。
(三)產(chǎn)品說明書和標簽樣稿
說明書��、標簽樣稿應(yīng)當符合《醫(yī)療器械說明書和標簽管理規(guī)定》及其他適用法規(guī)����、標準���、指導(dǎo)原則�、審評要點中有關(guān)說明書和標簽要求的規(guī)定����。
說明書內(nèi)容應(yīng)審查是否包括產(chǎn)品名稱、型號規(guī)格��、主要結(jié)構(gòu)及性能���、預(yù)期用途��、佩戴和調(diào)試���、工作條件(溫度��、濕度���、大氣壓力)、使用方法����、注意事項、保養(yǎng)和維護���、故障排除��、標簽和包裝標識����、生產(chǎn)日期��、生產(chǎn)許可證號��、注冊證號���、生產(chǎn)企業(yè)名稱��、地址���、聯(lián)系方式和使用期限����。其他內(nèi)容建議包含:
a)
1)安全操作的必要程序,應(yīng)考慮到不適當?shù)碾姎獍惭b可能導(dǎo)致B型應(yīng)用部分出現(xiàn)安全危險���。
2)設(shè)備可以與之安全連接的電氣安裝類型,包括與任何電位均衡導(dǎo)線的連接。
3)BF或者CF應(yīng)用部分的電極導(dǎo)電部分(包括中性電極)和其連接器,不應(yīng)與包括地在內(nèi)的其他導(dǎo)電部件接觸��。
4)當多個設(shè)備通過耦合和/或可移動式多孔插座相互連接時����,疊加的漏電流可能導(dǎo)致的危險。
b)
當使用特殊電池或電池充電程序才能滿足本產(chǎn)品的使用要求時,應(yīng)提供詳細說明�。
c)
若記錄儀可在潮濕環(huán)境下使用,應(yīng)提供使用時的詳細說明�。
d)
設(shè)備標簽應(yīng)清楚指示該設(shè)備是否可供嬰兒使用。
e)
制造商應(yīng)公布心率計算方法�。
f)
如果產(chǎn)品能對停搏進行提示,制造商應(yīng)公布停搏的識別方法��。四、參考文件
(一)適用和可參考的指導(dǎo)原則
《動態(tài)心電圖系統(tǒng)注冊技術(shù)審查指導(dǎo)原則》;
《一次性使用心電電極注冊技術(shù)審查指導(dǎo)原則》;
《醫(yī)療器械軟件注冊審查指導(dǎo)原則(2022年修訂版)》;
《醫(yī)療器械網(wǎng)絡(luò)安全注冊審查指導(dǎo)原則(2022年修訂版)》;《移動醫(yī)療器械注冊技術(shù)審查指導(dǎo)原則》;
《醫(yī)療器械可用性工程注冊審查指導(dǎo)原則》;
《醫(yī)療器械臨床評價技術(shù)指導(dǎo)原則》���。
(二)適用和可參考的標準
YY/T0196-2005《一次性使用心電電極》;
YY0828-2011《心電監(jiān)護儀電纜和導(dǎo)聯(lián)線》;
GB9706.1-2020《醫(yī)用電氣設(shè)備第1部分:基本安全和基本性能的通用要求》;
YY9706.102-2021《醫(yī)用電氣設(shè)備第1-2部分:基本安全和基本性能的通用要求并列標準:電磁兼容要求和試驗》;
YY9706.108-2021《醫(yī)用電氣設(shè)備第1-8部分:基本安全和基本性能的通用要求并列標準:通用要求���,醫(yī)用電氣設(shè)備和醫(yī)用電氣系統(tǒng)中報警系統(tǒng)的測試和指南》;
YY9706.111-2021《醫(yī)用電氣設(shè)備第1-11部分:基本安全和基本性能的通用要求 并列標準:在家庭護理環(huán)境中使用的醫(yī)用電氣設(shè)備和醫(yī)用電氣系統(tǒng)的要求》;
YY9706.247-2021《醫(yī)用電氣設(shè)備第2-47部分:動態(tài)心電圖系統(tǒng)的基本安全和基本性能專用要求》;
GB/T25000.51-2016《系統(tǒng)與軟件工程系統(tǒng)與軟件質(zhì)量要求和評價(SQuaRE)第51部分:就緒可用軟件產(chǎn)品(RUSP)的質(zhì)量要求和測試細則》;
GB/T14710-2009《醫(yī)用電器環(huán)境要求及試驗方法》;
YY/T1843-2022《醫(yī)用電氣設(shè)備網(wǎng)絡(luò)安全基本要求》;
GB/T16886.1-2022《醫(yī)療器械生物學(xué)評價第1部分:風(fēng)險管理過程中的評價與試驗》。
如有江浙滬皖長三角區(qū)域醫(yī)療器械注冊��、可穿戴式心電記錄設(shè)備注冊咨詢服務(wù)需求����,歡迎您隨時方便與杭州證標客醫(yī)藥技術(shù)咨詢有限公司聯(lián)絡(luò),聯(lián)系人:呂工�,電話:18058734169,微信同�。